實用的生物醫用鈦合金材料需滿足以下條件:良好的生物相容性、較低的彈性模量和密度、較好的防腐性且無毒、較高的屈服強度、較長的疲勞壽命,以及室溫下較大的塑性和易成形、易鑄造等特征[1]。

1964年,BREINE等[2]發現Ti-6Al-4V合金能夠與骨緊密結合。隨后,鈦合金在醫用外科手術中的應用獲得了成功。幾十年來,醫用鈦合金的發展經歷了三代:第一代是以純鈦和Ti-6Al-4V合金為代表的α型鈦合金;第二代是以Ti-5A1-2.5Fe、Ti-6Al-7Nb為代表的α+β型鈦合金。目前,醫療領域普遍使用的仍為第一、二代鈦合金。然而,一些研究者發現Al和V具有生物毒性,且V的毒性甚至超過Cr和NI,當含V元素的鈦合金植入病人身體時間較長后,V離子會聚集在各個器官,進而誘發癌癥,造成病人的二次傷害;而Al元素能以鋁鹽化合物的形式在體內積蓄,從而導致病人器官受損,誘發骨病、貧血和骨質軟化等病癥,嚴重時可引起神經疾病,如阿爾茨海默病[3-4]。此外,第一、二代鈦合金的彈性模量遠高于骨骼,由于植入物與骨骼間彈性模量不匹配,極易出現“應力屏蔽”現象,從而使植入體周圍的骨組織功能退化并吸收,進而導致植入體松動或斷裂[5]。于是,研究者開始進行第三代醫用鈦合金的研究,即用Nb、Zr、Sn、Mo、Ta、Hf等β穩定型元素代替Al和V等有害元素。
第三代鈦合金彈性模量更低、生物相容性更好,但卻具有強度較低、耐磨性較差等缺點。研究發現,在鈦合金中加入Nb元素可提高合金的塑韌性,還能改善冷加工后的合金性能;添加Mo元素可細化晶粒,提高合金強度,且改善冷、熱加工成形工藝;Zr和Mo元素具有良好的生物相容性;Ta和Hf由于成本較高,目前還停留于科學研究的實驗階段[3]。
近年來,β鈦合金主要形成了Ti-Nb、Ti-Mo、Ti-Zr和Ti-Ta系列,其中Ti-Nb和Ti-Zr系列鈦合金的研究較多[6-7]。本文著眼于制備工藝、處理工藝、生物相容性以及力學性能等方面,綜述了第三代生物醫用鈦合金的研究現狀。
1、制備工藝
目前,生物醫用鈦合金主要的制備方法為真空熔爐法、粉末冶金法、增材制造法、凝膠注模法等。
真空熔爐法[8]適用于小型鑄件、實驗室科學研究;研究者為了開發新型醫用鈦合金,減少制備成本或得到較小的鑄錠,普遍采用非自耗真空熔爐熔煉鑄錠,為后續醫學應用提供前期研究基礎。李培友等[8]采用非自耗真空熔爐熔煉鑄態低彈性模量生物醫用Ti-Nb-Sn合金,該合金具有較大的醫用價值。粉末冶金法[9]適合制備大型鑄件,可為醫學應用提供原錠,具有工藝簡單、生產流程短、原料利用率高、成本低,且鑄錠成分無偏析、組織細小均勻等優點。李霞[10]用粉末冶金近凈成形技術制備了性能優異的Ti2448合金。徐偉等[11]采用機械合金化結合放電等離子燒結工藝制備了Ti-8Mo-9Fe合金材料。李元元等[9]選用Ti-Nb-Zr-Ta-Fe合金體系,通過機械合金化合成非晶粉末,然后利用放電等離子燒結-非晶晶化法合成鈦基合金塊體,該鈦基合金的塑性和強度得到提高。李伯瓊等[12]研究了燒結溫度和燒結時間對鈦合金性能的影響,發現Ti-Nb-Ta-Zr合金的壓縮彈性模量隨燒結溫度的提高先增大后減小,且隨燒結時間的變化趨勢與此一致。何杰等[13]采用高速壓制和真空燒結的方法制備Ti-29Nb-13Ta-4.6Zr合金坯,當真空溫度為1250℃,且燒結時間為2.0H時,合金試樣具有最大的硬度和抗拉強度。
增材制造法[14]具有個性化、高柔性、低成本、短周期、成形性及組織性能控制一體化等特征,還具有孔徑、孔隙率可控性好,能量利用率高,適應的材料范圍廣等優點,分為粉床激光和粉床電子束兩大類。
李鑫[15]用激光熔化工藝制備出鈦基氧化鋯;宗洧安[16]用激光熔化工藝制備出Ti6Al4V-5Cu,該合金具有良好的成形性及較高的致密度(99.25%);韓立影等[17]利用“團簇+連接原子”結構模型構建了Ti-Fe-Zr-Y合金化雙團簇模型,由此設計了化學出成分為Ti64.52Fe29.32Zr5.86Y0.30的四元共晶合金,并利用激光快速成形技術在純鈦板上制備了該合金。
鈦基合金的彈性模量遠大于人體骨骼,但生物醫用多孔鈦合金材料具有獨特的多孔結構和更接近于人體骨骼的強度和彈性模量,故多孔鈦合金的制備引起了研究者的廣泛關注。凝膠注模法[18]易于制備形狀較復雜、尺寸較大的合金樣品,且樣品缺陷少、孔隙度可控,并易于成形,在高孔隙率植入件的制備方面具有很好的發展前景;但該方法存在對漿料的性能要求較高,工藝過程較復雜,制備成本過高等缺點。通過改變漿料固相含量可控制多孔β鈦合金的孔隙數量,從而改變合金的性能。厲俊鵬[19]采用凝膠注模和發泡相結合的工藝,制備了多孔Ti6Al4V合金,其孔隙率為70.53%,抗壓強度達到68.4MPa,壓縮彈性模量達到2.21GPa,且其韌性較好。
鈦基合金的制備方法各有特點,許多合金試樣均是在結合各種工藝的情況下獲得醫用成品,因此,可根據所需合金的性能和用途選擇合適的制備方法。隨著各種制備工藝的改進與創新,第三代生物鈦合金的發展將更加完善,其與人體骨骼的匹配性將不斷改善。
2、處理工藝
生物醫用鑄態鈦基合金的處理工藝主要包括冷軋或熱軋、時效、冷軋時效、激光噴丸、復合氧化、微弧氧化和仿生礦化等。鑄態合金錠普遍具有較大的顆粒尺寸和較低的強度,為了減小鑄錠的顆粒尺寸,提高合金的強度,一般鑄錠在時效處理前進行冷軋處理。陳旺等[20]發現Ti-7.5Nb-4Mo-2Sn合金的冷軋變形量越大,其冷軋織構及再結晶織構強度越高;且在650℃下退火得到的織構強度最高;當合金試樣中存在{111}〈112〉型γ織構時,超彈性能得到提高。
熱軋的作用是改變基體顆粒尺寸或再生第二相,提高合金的硬度和強度。王雪萌[21]在三種不同溫度下對Ti-6Mo-5V-3Al-2Fe合金進行熱軋,發現熱軋溫度處于相變點以下(800℃)時,熱軋試樣的微觀組織為變形β相晶粒和少量初生α相晶粒;當熱軋溫度在相變點以上(850℃)時,組織為細小的等軸β晶粒;而當熱軋溫度升至900℃時,晶粒發生了完全動態再結晶,組織為長大的等軸β晶粒。
部分研究者研究了鑄錠合金的時效工藝對組織和力學性能的影響,發現可以通過控制時效溫度或時效時間來調控合金的相組織,進而改善合金的力學性能。DU等[22]發現在相對較低的時效溫度(440℃)下,Ti-3Al-5Mo-6V-3Cr-2Sn-0.5Fe時效合金可析出體積分數較高、顆粒尺寸較小的二次α相,且具有較高的屈服強度。張浩宇等[23]指出Ti-6Mo-5V-3Al-2Fe合金經450℃時效后,由于β晶粒內析出了次生α相,時效合金獲得較高的抗拉強度;且隨著時效溫度升高,β晶粒內次生α相的尺寸和顆粒間距增大,導致時效合金強度降低。

為了獲得較小的鈦合金基體顆粒尺寸以及析出第二相,研究者普遍采用冷軋時效處理鑄態合金,進而獲得優異的力學性能。馬琰[24]將Ti-3.5Al-5Mo-6V-3Cr-2Sn-0.5Fe冷軋合金在750℃下固溶處理2mIN,然后在550℃下時效處理4H,結果發現大量次生α相在β基體上析出,合金的塑性和強度得到提高。陳旺等[20]對Ti-7.5Nb-4Mo-2Sn合金進行先冷軋后時效處理,650℃時效合金呈現出優異的彈性、較高的變形率和回復率。
為了提高鈦合金表面的強度、耐磨性和耐腐蝕性,激光噴丸強化、復合氧化以及微弧氧化[25]等處理工藝被普遍采用。孫昀潔等[26]對Ti6Al4V合金試樣表面進行激光噴丸強化處理,發現激光噴丸強化試樣的腐蝕傾向降低,鈍化性能更加穩定,腐蝕速率降低,耐生物腐蝕性能有效改善。GLERYZ等[27]利用復合氧化法處理Ti6Al4V合金,結果表明,在酸性環境中,經600℃氧化60H后,合金呈現出優異的耐腐蝕性,且在0.9%氯化鈉溶液中的耐磨性比未處理合金高25倍。微弧氧化處理可改變合金表面的生物性,從而提高合金在生物環境中的適應能力。通過微弧氧化在合金表面形成的多孔涂層的分層結構,能改善涂層附著力、潤濕性和細胞擴散。王偉強等[28]采用微弧氧化技術,在β型Ti-20Zr-10Nb-4Ta合金表面成功制備出由亞微米孔和層狀微米孔組成的分層涂層,該涂層具有生物活性,使鈦合金呈現出良好的細胞粘附和擴散性能,具有較大的生物醫學應用潛力。此外,通過微弧氧化技術在醫用Ti6Al4V合金表面構建粗糙多孔的微-納層狀結構,再經全氟辛基三氯硅烷乙醇溶液浸泡,可以使合金獲得超疏水表面;由于超疏水表面的潤濕性較差,細菌在其表面不易繁殖生長,從而起到抗菌作用[29]。
隨著生物醫用合金研究領域的擴展,研究者提出了仿生礦化[30]處理工藝,由于仿生磷灰石的成分接近于人體骨骼無機質,故其具有很高的生物相容性和骨結合能力,為低溫下共沉積蛋白質等生物大分子提供了可能性。仿生礦化工藝簡便,費用較低,能在形狀復雜和多孔的基體上形成均勻涂層。項艷凡等[31]通過仿生礦化處理,在純鈦上沉積了一層致密的碳酸化羥基磷灰石,礦化合金與骨結合緊密;制備的羥基磷灰石涂層與骨細胞接觸6H后,骨細胞在材料表面明顯附著。
3、生物相容性
生物醫用鈦合金可用作硬組織替代物或軟組織替代物,此類Ti合金除應具有低的彈性模量、較高的強度和塑性外,還需具有生物相容性,也就是生物活性與植入體周圍環境匹配。微弧氧化技術在鈦表面制備的摻硅多孔二氧化鈦涂層被證明與細胞相容[32]。王全名等[32]通過觀察成骨細胞(MC3T3-E1細胞)的形態、增殖、分化和礦化等,對硅二氧化鈦涂層的生物活性進行了詳細的體外研究。與二氧化鈦涂層和鈦板上的細胞相比,種植在硅二氧化鈦涂層上的細胞增殖速率明顯更快,且能更好地粘附在發育成熟的細胞骨架上,即細胞骨架的大量肌動蛋白應激纖維出現在細胞膜中。
成骨基因表達分析表明,硅二氧化鈦涂層能刺激成骨細胞相關基因的表達,進而促進MC3T3-E1細胞的分化和礦化。因此,硅鈦涂層是一種很好的生物相容植入體材料[32]。翁正陽[33]制備出一種TiO2納米管/可降解雜化高聚物多孔支架,該支架利于鈣磷層的沉積及其表面親水性能的提高;TiO2納米管的中空結構可負載各種無機、有機和小分子藥物;以布洛芬為模型藥物,可降解高聚物對其具有較長的緩釋時間。項艷凡等[31]通過仿生礦化處理,在純鈦表面上沉積了一層致密的碳酸化羥基磷灰石,研究發現該沉積層與骨組織結合緊密,吸附了更多的蛋白質,從而提高了成骨細胞的初期附著率。
KHERADMANDFARD等[34]研究指出,細胞在超聲波納米晶體表面改性標本上比在未處理的標本上更易粘附和擴散,且細胞粘附面積提高2倍以上。
4、力學性能
為了滿足鈦合金的醫用需求,一些研究者們對鈦合金的力學性能進行了研究,結果如表1所示。
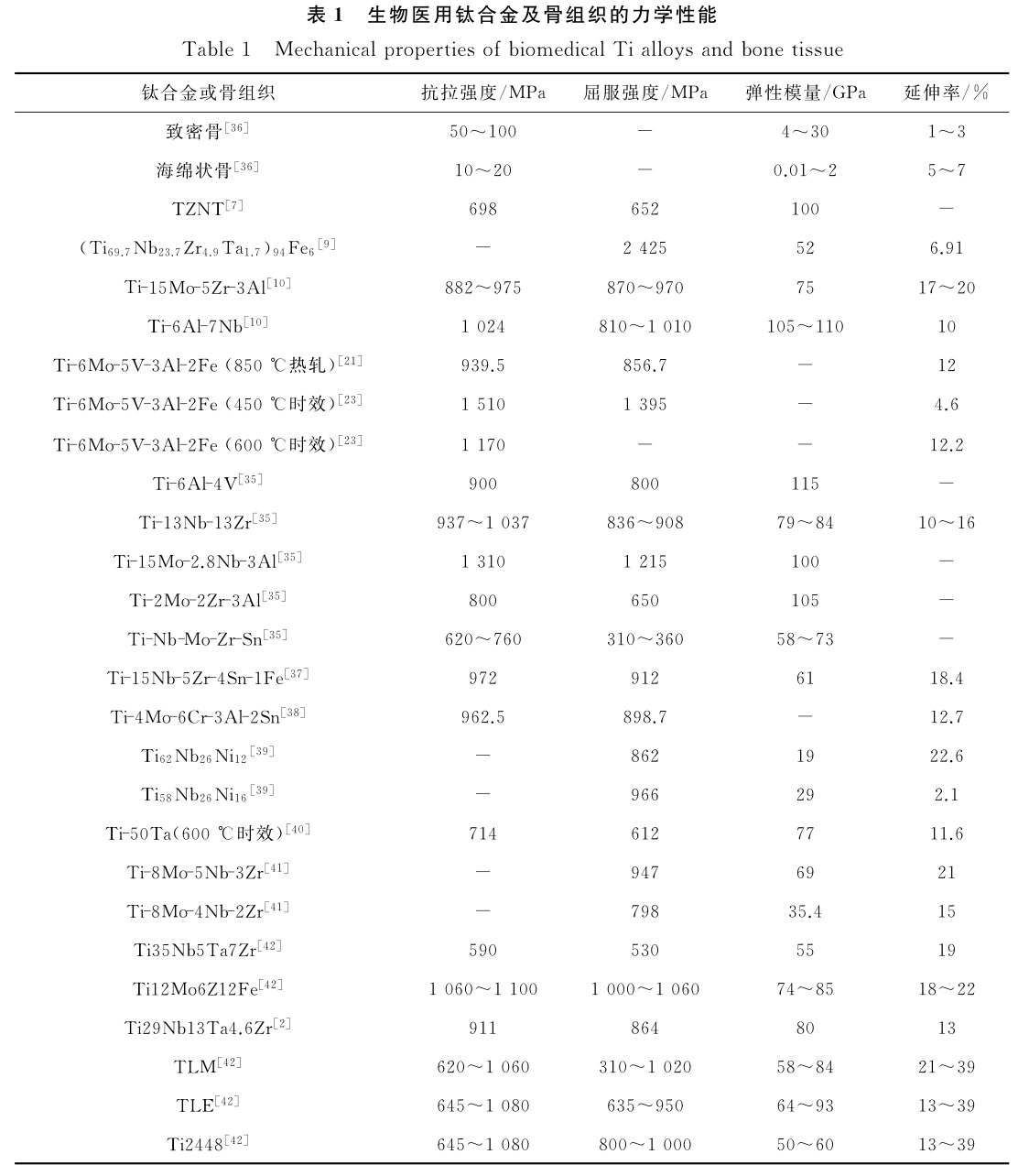
由表1可知,致密骨的抗拉強度可達到50~100MPa,抗壓強度在80~230GPa,大于抗拉強度;而彈性模量卻在4~30GPa范圍,延伸率為1%~3%,近似為脆性斷裂。海綿狀骨的抗拉強度和彈性模量更低。生物醫用合金的抗拉強度、彈性模量以及延伸率均大于致密骨組織。低的彈性模量、高的強度以及大的延伸率,是較理想的醫用硬組織植入體材料需具備的性能。因此,醫用鈦合金的力學性能指標主要體現在強度、彈性模量和延展性上,研究者們采用微量元素添加法或對鈦合金鑄錠進行處理,進而改善合金力學性能[9,35]。李元元等[9]將微量Fe元素添加到Ti69.7Nb23.7Zr4.9TA1.7合金中,制備的(Ti69.7Nb23.7Zr4.9TA1.7)94Fe6超細晶合金的屈服強度高達2425MPa,斷裂強度高達2650MPa,斷裂應變達6.91%,平均彈性模量低至52GPa,可見其為一種優異的生物醫用材料。在室溫下燒結態Ti-13Nb-13Zr合金[35]的抗拉強度最高可達1037MPa,延伸率最高可達16%。將微量的Nb和Al元素加入Ti-Mo合金,形成的Ti-15Mo-2.8Nb-3Al合金[35]抗拉強度達到1310MPa,且屈服強度也高達1215MPa,但彈性模量高于人骨的彈性模量。
冷軋時效處理可改善合金基體的顆粒大小或析出第二相,進而提高合金的強度或降低彈性模量。ZHANG等[23]發現Ti-6Mo-5V-3Al-2Fe合金經450℃時效后,β基體內形成針狀的次生α相,抗拉強度可達1510MPa;該合金經600℃時效后,延伸率提高到12.2%,抗拉強度達到1170MPa。王雪萌
[21]對Ti-6Mo-5V-3Al-2Fe合金進行850℃熱軋,熱軋后合金抗拉強度可達939.5MPa,屈服強度可達856.7MPa,斷后伸長率為12.0%。易瓊華[43]研究了時效和固溶處理對Ti-Zr-Ta合金力學性能的影響,發現合金經時效處理后發生調幅分解,隨后再進行固溶處理,則隨著Zr含量的增加,合金的屈服強度提高,彈性模量下降;其中Ti-40Zr-20Ta具有較高的屈服強度(1769MPa)和較低的彈性模量(83GPa),綜合力學性能較好。FU等[37]提出了一種在α+β雙相結構鈦合金中實現低彈性模量和高屈服強度的思路,通過成分優化和熱機械處理,研制出一種α+β型Ti-15Nb-5Zr-4Sn-1Fe合金;通過熱軋和隨后在α+β區退火形成嵌入亞穩β基體的超細晶α相,實現了低彈性模量和高屈服強度的良好結合。
王永善等[8]研究Ti-Nb-Sn合金時發現,通過時效處理鑄錠可降低Ti87Nb8Sn5合金的彈性模量,且彈性模量隨著時效溫度升高而降低,經973K時效處理后,合金彈性模量為36.2GPa,非常接近人骨。其他醫用合金[36,38-42]的力學性能也列于表1中。
在難熔高熵醫用合金的研究中,HUA等[44]分別調整各元素的含量以確定力學性能最優的合金成分,結果表明,體心立方固溶體結構的鈦鋯基難熔高熵合金表現出高硬度和良好的耐磨性,如Ti-Zr-Nb-Ta-Mo合金表現出比Ti6Al4V合金更好的干、濕耐磨性;隨著Ti含量的降低,難熔Ti-Zr-Nb-Ta-Mo高熵合金的耐磨性提高,且合金在濕摩擦條件下的磨損率低于干摩擦條件下的磨損率;Ti-Zr-Nb-Ta-Mo合金在磷酸鹽溶液中具有較低的腐蝕速率以及較穩定的鈍化膜。
5、結語與展望
目前,鈦基合金材料在骨科應用中比其他金屬生物材料具有明顯優勢,鈦基合金的增材制造仍在逐步發展[45]。CP-Ti和Ti6Al4V是臨床應用最廣泛的植入體材料,但均有一定的缺點。這些植入體材料的彈性模量雖然小于不銹鋼和鈷基合金,但仍大于人骨的彈性模量。β鈦植入體的發展已達到降低彈性模量和提高疲勞強度的目的。雖然β型鈦合金的彈性模量小于不銹鋼和鈷基合金的彈性模量,但仍大于人骨的彈性模量。彈性模量較低(約為55GPa[46])的鈦合金材料已被開發,且該合金具有較低的耐磨性。
添加不同的元素已被用來改善鈦植入體材料的微觀結構和力學性能。更多的多孔植入體材料也受到了特別的關注,因其有助于降低彈性模量并促進人骨向內生長。研究者們仍在努力開發生物相容性更好的植入體材料。此外,不同的表面處理工藝被用于改善鈦合金植入體材料的性能,如耐磨性、耐腐蝕性和骨組織結合性。采用不同的先進制備工藝,然后進行適當的表面涂層改性,可獲得滿足醫用性能要求的鈦合金植入體材料。開發出堅韌、生物相容、耐腐蝕、耐磨、彈性模量更接近人骨的植入體材料[47],仍是研究者們努力的方向。
參考文獻:
[1]NIINOMIM.MecHaNIcAlbIocoMPaTibIlITiesoFTiTaNIUmAlloysForbIomeDIcAlaPPlIcaTiON[J].JoUrNAloFTHeMe-cHaNIcAlBeHavIoroFBIomeDIcAlMaTerIAls,2008,1:30-42.
[2]BREINEU,JOHANSSONB,ROYLANCEPJ,eTAl.Re-GeNeraTiONoFboNemarroW.AclINIcAlaNDeXPerImeNTalsTUDyFolloWINGreMovAloFboNemarroWbyCureTTaGe[J].AcTaANaTomIca,1964,59:1-46.
[3]PITCHICS,PRIYADARSHINIA,SANAG,eTAl.Are-vIeWoNAlloycomPosITiONaNDsyNTHesIsoFβ-TiTaNIUmAl-loysForbIomeDIcAlaPPlIcaTiONs[J].MaTerIAlsToDay:ProceeDINGs,2020,26:3297-3304.
[4]WANGK.THeUseoFTiTaNIUmFormeDIcAlaPPlIcaTiONINTHeUSA[J].MaTerIAlsScIeNceaNDENGINeerINGA,1996,213:134-137.
[5]CHEAlE,SPECTORM,HAYESW.RoleoFloaDsaNDProsTHesesmaTerIAlProPerTiesoNTHemecHaNIcsoFTHeProXImAlFemUraFTerToTalHIParTHroPlasT[J].JoUrNAloFOrTHoPaeDIcResearcH,1992,10:405-422.
[6]魏芬絨,王海,金旭丹,等.生物醫用鈦合金材料及其應用[J].世界有色金屬,2018(2):260-262.
[7]李佐臣,周廉,李軍,等.外科植入物用第三代新型醫用鈦合金研究[J].鈦工業進展,2003(Z1):46-48.
[8]王永善,李培友,馬昕迪,等.熱處理溫度對生物醫用Ti87Nb8Sn5合金微觀組織和力學性能影響[J].材料熱處理學報,2020,41(7):49-56.
[9]李元元,鄒黎明,楊超.粉末冶金法合成高強低模超細晶醫用鈦合金[J].華南理工大學學報(自然科學版),2012,40(10):43-50.
[10]李霞.粉末冶金制備生物醫用鈦合金[D].哈爾濱:哈爾濱工業大學,2019.
[11]徐偉,路新,夏青,等.粉末冶金超細晶醫用Ti-Mo-Fe合金的制備與表征[J].稀有金屬材料與工程,2017,46(5):1393-1398.
[12]李伯瓊,謝瑞珍,李春林.燒結工藝對醫用Ti-Nb-Ta-Zr合金微觀結構及性能的影響[J].粉末冶金工業,2020,30(3):58-63.
[13]何杰,肖志瑜,楊碩,等.Ti-29Nb-13Ta-4.6Zr高速壓制行為及其燒結性能的研究[J].粉末冶金工業,2017,27(5):12-17.
[14]陳剛,路新,張林,等.鈦及鈦合金粉末制備與近凈成形研究進展[J].材料科學與工藝,2020,28(3):98-107.
[15]李鑫.鈦基氧化鋯復合材料選區激光熔化工藝及組織性能研究[D].濟南:山東大學,2020.
[16]宗洧安.生物醫用鈦合金增材制造成形工藝及性能研究[D].沈陽:沈陽工業大學,2020.
[17]韓立影,王存山,羌建兵.激光快速成形Ti64.52Fe29.32-Zr5.86Y0.30醫用合金組織與性能[J].中國有色金屬學報,2018,28(3):474-482.
[18]許瑩,王歡歡,王變.醫用多孔鈦合金的制備方法研究進展[J].鈦工業進展,2018,35(3):1-5.
[19]厲俊鵬.醫用多孔Ti6Al4V合金的制備及力學性能研究[D].杭州:浙江大學,2020.
[20]陳旺,孫洪吉,龔倫軍,等.冷軋變形量及退火溫度對Ti-7.5Nb-4Mo-2Sn合金織構和超彈性的影響[J].材料熱處理學報,2018,39(8):20-27.
[21]王雪萌.TiMoVAlFe合金的軋制工藝及其性能[D].沈陽:沈陽工業大學,2018.
[22]DUZX,XIAOSL,XULJ,eTAl.EFFecToFHeaTTreaT-meNToNmICrosTrUcTUreaNDmecHaNIcAlProPerTiesoFaNeWβHIGHsTreNGTHTiTaNIUmAlloy[J].MaTerIAlsaNDDesIGN,2014,55:183-190.
[23]ZHANGHaoyU,LIXIaoHUI,LINLI,eTAl.EFFecToFaGINGTemPeraTUreoNmICrosTrUcTUrAlevolUTiONaNDme-cHaNIcAlProPerTiesoFaNovelβTiTaNIUmAlloy[J].RareMeTalMaTerIAlsaNDENGINeerING,2019,48(12):3812-3818.
[24]馬琰.冷軋高強β鈦合金組織演變及強化機理研究[D].呼和浩特:內蒙古工業大學,2019.
[25]余國慶,高書刊,王國迪,等.鈦合金微弧氧化工藝及性能評價[J].熱加工工藝,2021,50(6):13-17.
[26]孫昀杰,周建忠,黃舒,等.激光噴丸醫用Ti6Al4V合金的耐生物腐蝕性能研究[J].中國激光,2017,44(7):295-301.
[27]GLERYZH,IMENOLUH.EFFecToFTHermAloX-IDaTiONoNcorrosIoNaNDcorrosIoN-WearbeHavIoUroFaTi-6Al-4VAlloy[J].BIomaTerAls,2004,25(16):3325-3333.
[28]WANGWeIqIaNG,ZHENGXINGcHUaN,YUFeNGyUN,eTal.FormaTiONaNDcyTocoMPaTibIlITyoFaHIerarcHIcAlPor-oUscoaTiNGoNTi-20Zr-10Nb-4TaAlloybymICro-arcoX-IDaTiON[J].SUrFaceaNDCoaTiNGsTecHNoloGy,2020,404:126471.
[29]姜久仰,劉宏宇,徐吉林,等.醫用Ti-6Al-4V合金表面氟硅烷超疏水涂層的制備及生物學性[J].稀有金屬材料與工程,2019,48(6):1884-1891.
[30]于洋.燒結鋼燒結過程中的氣氛控制及其對性能的影響[J].粉末冶金技術,2002,20(4):239-243.
[31]項艷凡,王迎軍,鄧飛龍.鈦表面仿生礦化及其對成骨細胞行為的影響[J].材料科學與工程學報,2005,23(2):239-243.
[32]WANGQUaNmING,HUHoNGJIe,QIAOYUqING,eTAl.ENHaNceDPerFormaNceoFosTeoblasTsbysIlIcoNINcor-PoraTeDPoroUsTiO2coaTiNG[J].JoUrNAloFMaTerIAlsScIeNce&TecHNoloGy,2012,28(2):109-117.
[33]翁正陽.TiO2醫用鈦植入體表面功能化改性及其載藥性能的研究[D].武漢:湖北大學,2015.
[34]KHERADMANDFARDM,KASHANI-BOZORGSF,LEEJS,eTAl.SIGNIFIcaNTImProvemeNTINcellaDHesIoNaNDWearresIsTaNceoFbIomeDIcAlβ-TyPeTiTaNIUmAlloyTHroUGHUlTrasoNIcNaNoCrysTalsUrFaceMoDIFIcaTiON[J].JoUrNAloFAlloysaNDComPoUNDs,2018,762:941-949.
[35]許艷飛.新型醫用β鈦合金的設計、制備及其固溶時效行為[D].長沙:中南大學,2012.
[36]楊坤.粉床電子束增材制造生物醫用鈦合金的組織與性能研究[D].長春:吉林大學,2020.
[37]FUYU,XIAOWeNloNG,WANGJUNsHUaI,eTAl.ANovelsTraTeGyForDeveloPINGα+βDUAl-PHaseTiTaNIUmAlloysWITHloWYoUNG′sMoDUlUsaNDHIGHyIelDsTreNGTH[J].JoUrNAloFMaTerIAlsScIeNce&TecHNoloGy,2021,76:122-128.
[38]王鵬宇,張浩宇,張志鵬,等.固溶溫度對亞穩β鈦合金Ti-4Mo-6Cr-3Al-2Sn的組織和拉伸性能的影響[J].材料研究學報,2020,34(6):473-480.
[39]LIPeIyoU.MICrosTrUcTUrAlaNDmecHaNIcAlProPerTiesoFNovelβ-TyPeTi-Nb-NIAlloyscoNTaININGasecoNDPHase[J].
INTerNaTiONAlJoUrNAloFMaTerIAlsResearcH,2018,109(8):708-715.
[40]ZHOUYL,NIINOMMIM.MICrosTrUcTUresaNDme-cHaNIcAlProPerTiesoFTi-50mass%TaAlloyForbIome-DIcAlaPPlIcaTiONs[J].JoUrNAloFAlloysaNDCom-PoUNDs,2008,466(1-2):535-542.
[41]NNAMCHIPS,OBAYICS,TODDI,eTAl.MecHaNIcAlaNDelecTrocHemIcAlcHaracTerIzaTiONoFNeWTi-Mo-Nb-ZrAlloysForbIomeDIcAlaPPlIcaTiONs[J].JoUrNAloFTHe
MecHaNIcAlBeHavIoroFBIomeDIcAlMaTerIAls,2016,60:68-77.
[42]李岳.醫用鈦合金Ti13Nb13Zr力學性能的研究[D].太原:太原理工大學,2019.
[43]易瓊華.基于調幅分解的低模量高強度Ti-Zr-Ta合金設計與顯微組織和力學[D].湘潭:湘潭大學,2020.
[44]HUANeNGbIN,WANGWeNJIe,WANQIaNTiNG,eTAl.MecHaNIcAl,corrosIoN,aNDWearProPerTiesoFbIomeDI-cAlTi-Zr-Nb-Ta-MoHIGHeNTroPyAlloys[J].JoUrNAloFAlloysaNDComPoUNDs,2021,3:157997.
[45]ATTaRH,EHTEMAM-HAGHIGHIS,SORON,eTal.ADDITivemaNUFacTUrINGoFloW-cosTPoroUsTiTaNIUm-baseDcomPosITesForbIomeDIcAlaPPlIcaTiONsaDvaNTa-Ges,cHAlleNGesaNDoPINIoNForFUTUreDeveloPmeNT[J].JoUrNAloFAlloysaNDComPoUNDs,2020,827:154263.
[46]KAURM,SINGHS.RevIeWoNTiTaNIUmaNDTiTaNIUmbaseDAlloysasbIomaTerIAlsFororTHoPaeDIcaPPlIcaTiONs[J].MaTerIAlsScIeNceaNDENGINeerINGC,2019,102:844-862.
[47]SIDHUSS,SINGHH,GEPREELMA.ArevIeWoNAlloyDesIGN,bIoloGIcAlresPoNse,aNDsTreNGTHeNINGoFβ-TiTaNIUmAlloysasbIomaTerIAls[J].MaTerIAlsScIeNceaNDENGINeerINGC,2021,121:111661.
相關鏈接










