形狀記憶合金(shape memory alloys,SMA)是一類具有在熱機械變形或磁變形等特定刺激作用下保持預編程形狀能力的形狀記憶材料[1]。自1932 年 SMA被發現后,已發現幾十種不同的合金材料具有形狀記憶效應,可概括為鎳鈦(NiTi)合金、鐵基合金、鎂基合金和銅基合金[2]。由于具有優異的生物相容性[3]、穩定性[4]和熱機械性能,以 NiTi合金(nickel-titanium alloy或 Ni-Ti alloy)為基礎的 SMA在大多數應用中更為可取,如航空航天、骨科植入物和固定裝置、聯接器和緊固件、電氣安全裝置、海軍、運動設備以及外科手術器械等[5-6]。
然而,由于鎳鈦合金中含鎳量達50 at%左右,一旦植入體發生腐蝕,鎳離子(Ni2+)就會溶出向四周擴散導致細胞畸變,甚至產生癌變作用,影響其本身性能,從而限制了它在醫學領域的長期使用[7]。為此,國內外學者嘗試做了大量的表面處理,采用物理化學、電化學、形態學及生物化學等多種方法對鎳鈦記憶合金表面進行改性,如等離子噴涂
[8]、離子注入[9]、電解拋光[10]、陽極氧化[11]、酸堿處理[12]等,這些技術均在不同程度上取得了良好的效果,但都有各自的不足之處。孫向東等[13]研究指出,鎳鈦合金去合金化的實現途徑有兩種:一是降低去合金液內的鎳離子濃度;二是在表面形成穩定的鈦氧化物。因此本研究選用強氧化劑過氧化氫溶液對鎳鈦合金進行處理,旨在確保其生物安全性的同時,能在鎳鈦合金表面形成穩定的氧化物。
本研究將對3D打印鎳鈦合金進行去合金化處理并與酸蝕處理對比,研究其理化特征、成骨活性功能,旨在探究一種更加簡便、高效的表面處理方式,以保障其安全性,并提升它的耐腐蝕能力及生物性能,為鎳鈦合金作為醫用材料特別是植入 /介入器械的長期安全臨床應用,提供可借鑒的思路和理論指導。
一、材料與方法
1、主要材料及試劑、儀器:
鎳鈦合金粉末(德普潤新材料,北京);人骨髓間充質干細胞(human bone marrow mesenchymalstem cells,hBMSCs)(佳木斯大學基礎醫學院提供);過氧化氫溶液(大茂化學試劑,天津);鹽酸溶液(歐博凱化工,天津);硫酸溶液(歐博凱化工,天津);MEM培養基(Biosharp,上海);胎牛血清(Gibco,美國);CCK-8 細胞檢測試劑盒(Beyotime,上海);Mlab 3D打印機(GE Additve,美國);FV1000 激光共聚焦顯微鏡(Olympus,日本);JC200001 接觸角測量儀(中晨設備,上海);RS232 多功能酶標儀(麥莎生物,上海)。
2、實驗分組及方法:
使用 Geomagic Design X軟件進行設計建模,鎳鈦試件尺寸設計為直徑10 mm、厚度為2 mm的圓片,將數據導入3D打印機中,選擇鎳鈦合金打印參數進行打印,本實驗使用的鎳鈦合金粉末為平均粒徑10~53 μm的球形近等原子比粉末。
A組:使用150 目 Al2O3 砂礫,噴砂角度為90°,壓強為0.2 MPa,時間60 秒,對樣品進行噴砂處理。
B組:將以上噴砂后的試樣放入70℃的鹽酸與硫酸(濃度比例1:1)溶液中酸蝕處理60 分鐘。
C組:將噴砂處理后的試樣置于80℃濃度為15%、pH為3 的過氧化氫溶液中3 小時,進行去合金處理。
3、 觀測指標:
(1)表面理化性能表征:
每 組 各 取1 個 樣 品, 用 掃 描 電 子 顯 微 鏡(scanning electron microscope, SEM) 觀 察 表 面形貌特征;每組取3 個樣品,用能譜儀(energydispersive spectrometer, EDS)對各組表面成分進行分析,測量后取均值;室溫下用接觸角測量儀測量表面接觸角。
(2)體外細胞相容性評價:
①細胞培養48 小時后每組各取1 個樣品,處理后加入鬼筆環肽與赫斯特細胞核藍色熒光染料(Hoechst 33342)分別進行細胞骨架和細胞核染色,然后利用激光共聚焦掃描顯微鏡(laserscanning confocal microscope, LSCM)對細胞位置和蛋白骨架進行觀察。每組取3 個樣品置于24孔板中,每孔加入3×104 個 hBMSCs 懸液500 μL與試樣共培養,置于37℃、5% CO2 培養箱培養1、3、5 天后,每組5 個復孔,用 CCK-8 試劑盒進行檢測。②在滅菌后的試樣表面以2×104 個細胞 /每孔接種,并用完全培養基培養,3 天后換 成誘導培養基培養,隔天更換1 次培養基,采用天狼星紅染色方法測定 I型膠原分泌情況。③茜素紅染色法測定細胞外基質的礦化程度。
4、 統計學方法:
采用 Graphpad Prism 8 進行統計分析,實驗結果采用平均值 ±標準差表示,如果 P<0.05,則認為差異具有統計學顯著性。
二、實驗結果
1、 表面理化性能表征:
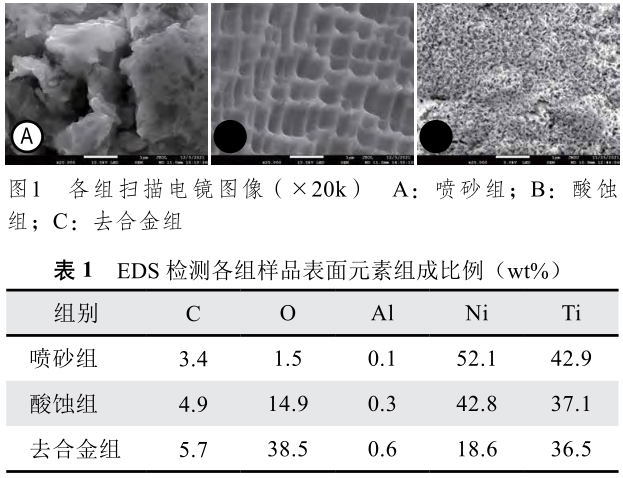
SEM結果顯示噴砂組表面呈形狀不規則的凹坑和沖擊痕;酸蝕組形成類似纖維網格狀的結構;去合金組表面獲得了均勻、多孔的納米網架結構(圖1)。
EDS結果如表1,去合金后表面鎳元素(Ni)含量比其他兩組明顯降低,為18.6 wt%,氧元素(O)含量也較其他兩組高。
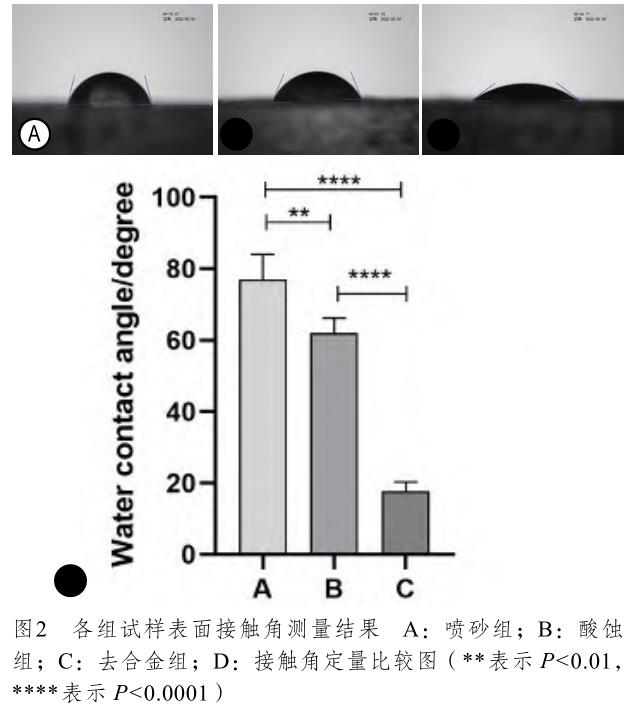
接觸角測量儀檢測結果如圖2,噴砂組、酸蝕組和去合金組的表面水接觸角分別為76.99°±7.03°、62.05°±4.14°和17.67°±2.66°,組間比較差異均有統計學意義(P<0.01)。
2、體外細胞相容性評價:
(1)細胞形態觀察:
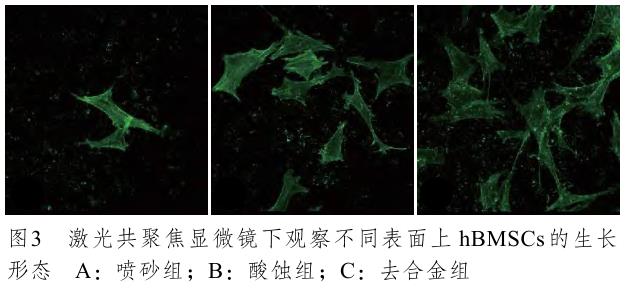
圖3 所示,在噴砂處理后,表面上 hBMSCs數量較少且未見到偽足生長,也無明顯的鋪展;在酸蝕處理組試樣的表面,細胞的生長形態相似,偽足增多,向四周鋪展,細胞數量也有所增加;在去合金組的試樣表面,所有細胞都鋪展良好,覆蓋的面積也較其他組增大,并且向三維方向伸展,偽足和胞間連絲都增加,細胞之間已沒有了界限。
(2)細胞增殖實驗:
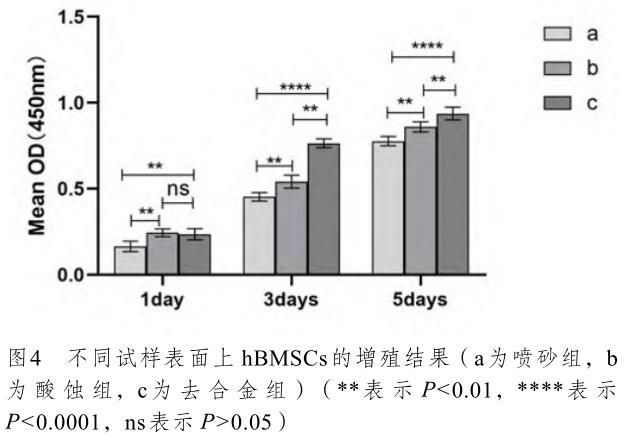
CCK-8 細胞增殖實驗檢測結果顯示,培養1、3、5 天后,各組細胞的生長速度隨著培養時間的延長呈遞增趨勢,不同時間點的比較有顯著性差異(P<0.05)。實驗結果證明,去合金組試樣表面的細胞增殖最快,酸蝕組次之,噴砂組最慢(圖4)。
(3)細胞分化能力檢測:
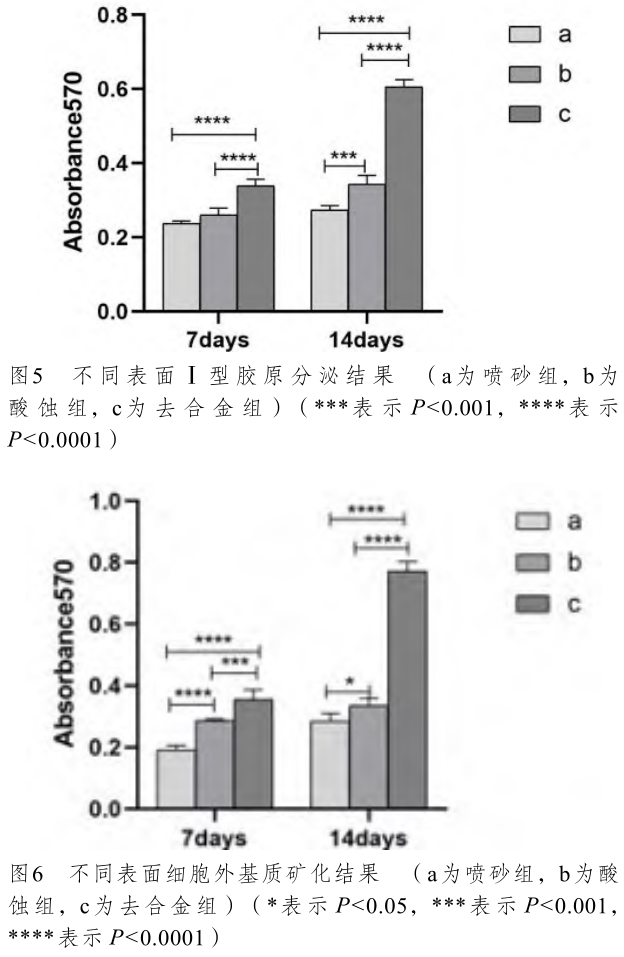
圖5、圖6 分別是不同樣品表面誘導細胞培養7 天和14 天后Ⅰ型膠原分泌與細胞外基質礦化的結果,隨著誘導時間延長,去合金組的Ⅰ型膠原和細胞外基質礦化水平增加最多,增長速度也較其他組更快,說明去合金化處理能夠促進 hBMSCs分化,且隨著誘導時間延長,對hBMSCs分化的促進作用更明顯。
三、討論
作為植入材料,未經處理的3D打印鎳鈦合金表面由于較粗糙,沒有微孔結構,不利于細胞的識別和黏附,且其在接觸體液時,因為腐蝕可能導致植入體鎳離子的釋放,可能會對人體產生毒性[14-15],因此必須不斷通過各種表面處理方法提高鎳鈦合金植入物的理化特性,從而增強植入物的生物學性能,提高生物相容性,促進植入體與骨組織的結合,縮短愈合時間。去合金是一種以化學或電化學的方式,對一種或幾種金屬進行選擇性的蝕刻,然后用不同材料之間的電勢差異,將一種以上的活性金屬離子進行選擇性的溶解,以獲得具有連續的十納米到幾百微米的三維孔隙結構[16]。目前,去合金法由于其經濟、高效、可控等優點在納米多孔體的制造中得到了越來越多的重視,但目前國內對鎳鈦合金去合金的相關報道較少,且去合金后的鎳鈦合金生物相容性有待進一步檢驗。
本研究中去合金處理后的表面較其他兩組形成更加豐富的納米級網架結構,說明它可以使噴砂后的不規則表面產生多級孔隙,也因此可以消除噴砂后表面形成的不規則淺坑,而且相較于酸蝕后的表面,去合金可以使表面孔洞加深、數量增多,排列也更緊密,為表面親水性能提供了形貌基礎。本實驗結果可見,與其他兩組相比,去合金表面的鎳元素含量降至18.6 wt%,大大降低了鎳離子釋放對人體產生毒性的可能;在去合金組,氧元素的含量也明顯增加,表明其對金屬的氧化有一定促進作用,在其表面可能形成親水性的氧化鈦膜層[17]。
理想的植入體應具有良好的細胞相容性和良好的成骨活性。本研究在去合金化的過程中,表面增加了納米級網格結構,為細胞的附著和延伸創造了更多空間,從而使其更多地向三維方向延伸,而圍繞著網格突起的邊緣也“錨定”了由細胞延伸出來的偽足,并且與試件接觸更加緊密。表明隨著植入體潤濕性的增大,其擴展區域也隨之增大[18]。Hallab等[19]的實驗還表明,植入體的表面與親水性的關系比,表面粗糙度對其影響更明顯。從體外細胞活性實驗可以看出,各組樣品都支持細胞的增殖與分化,隨著植入體浸潤性的增強,其細胞增殖能力和骨結合能力也隨之增強[20],同時也說明骨髓間充質干細胞能夠承受樣品釋放的 Ni2+,有研究也證明等原子比鎳鈦合金對細胞具有極低的毒性,表明其具有良好的生物相容性[21]。
本研究中去合金化形成的納米級網格狀結構表面是一種良好的表面改性方法,優化了試件的表面性能,具有良好的細胞相容性,并且能夠促進成骨功能的表達,有望改善鎳鈦植入物的骨結合能力和植入物的長期穩定,但其在體內的相關指標驗證還需進一步通過動物實驗來實現。
利益沖突 本文作者均聲明不存在利益沖突作者貢獻聲明 秦欣玉:實驗設計、實驗實施、數據分析和論文寫作等全過程;張亮、陳瑩瑩、韓澤奎:參與實驗實施;宿玉成、王心彧:提供研究經費、論文修改和審閱指導。
參考文獻
[1]Mohd Jani J, Leary M, Subic A, et al. A review of shape memory alloy research, applications and opportunities[J].Materials and Design, 2014,56:1078-1113.DOI:10.1016/j.matdes.2013. 11.084
[2]譚樹松 . 形狀記憶合金研究的最新進展及應用 [J]. 功能材料 ,1991,3:185-190,192.
[3]Patel S K, Behera B, Swain B, et al. A review on NiTi alloys for biomedical applications and their biocompatibility[J].Materials Today: Proceedings, 2020,33:5548-5551.DOI:10.1016/j.matpr. 2020.03.538.
[4]Mani G, Porter D, Grove K, et al. Surface finishing of nitinol for implantable medical devices: a review[J]. JBiomed Mater Res B Appl Biomater, 2022,110(12):2763- 2778. DOI: 10.1002/jbm.b.35112.
[5]Nair VS, Nachimuthu R. The role of NiTi shapememory alloys in quality of life improvement through medical advancements: a comprehensive review[J].
Proc Inst Mech Eng H, 2022,236(7):923-950. DOI:10.1177/09544119221093460.
[6] Bhagyaraj J, Ramaiah K V, Saikrishna C N, et al. Behavior and effect of Ti2Ni phase during processing of NiTi shape memory alloy wire from cast ingot[J].Journal of Alloys andCompounds , 2013,581:344-351.
[7]Mo?nik P, Kosec T. A critical appraisal of the use and properties of nickel-titanium dental alloys[J]. Materials (Basel), 2021,14(24):7859. DOI: 10.3390/ma14247859.
[8] Bogdanski D, Epple M, Esenwein S A, et al.Biocompatibility of calcium phosphate-coated and of geometrically structured nickel–titanium (NiTi) by in vitro testing methods[J]. Materials Science & Engineering.A, Structural Materials : Properties, Microstructure and Processing, 2004,378(1): 527-531. DOI:10.1016/ j.msea.2003.11.071
[9]Wu SL, Chu PK, Liu XM, et al. Surface characteristics,mechanical properties, and cytocompatibility of oxygen plasma-implanted porous nickel titanium shape memory alloy[J]. J Biomed Mater Res A, 2006,79(1):139-146. DOI:10.1002/jbm.a.30705.
[10]Kim J, Park JK, Kim HK, et al. Optimization of electropolishing on NiTi alloy stents and its influence on corrosion behavior[J]. J Nanosci Nanotechnol, 2017,17(4):2333-2339. DOI: 10.1166/jnn.2017.13324.
[11]Mohammadi F, Golafshan N, Kharaziha M, et al. Chitosan-heparin nanoparticle coating on anodized NiTi for improvement of blood compatibility and biocompatibility[J].Int J Biol Macromol, 2019,127:159-168. DOI: 10.1016/j.ijbiomac.2019.01.026.
[12]Lee SY, Lee CH, Kim DY, et al. Preparation and photocatalytic activity of potassium- incorporated titanium oxide nanostructures produced by the wet corrosion process using various titanium alloys[J]. Nanomaterials (Basel),2015,5(3):1397-1417. DOI: 10.3390/nano5031397.
[13]蘇向東 , 王天民 , 郝維昌 , 等 . 低溫去合金化處理對醫用鎳鈦合金表面性質的影響 [J]. 稀有金屬材料與工程 ,2008,37(5):859-863. DOI: 10.3321/j.issn:1002-185X.2008. 05.026.
[14]Pound BG. The electrochemical behavior of nitinol in simulated gastric fluid[J]. J Biomed Mater Res B Appl Biomater, 2017,105(8):2394-2400. DOI: 10.1002/jbm. b.33779.
[15]Pound BG. Corrosion behavior of nitinol in blood serum and PBS containing amino acids[J]. J Biomed Mater Res B Appl Biomater, 2010,94(2):287-295. DOI: 10.1002/jbm.b.31647.
[16] Song T, Gao Y, Zhang Z, et al. Dealloying behavior of rapidly solidified Al–Ag alloys to prepare nanoporous Ag in inorganic and organic acidic media[J]. CrystEng Comm,2011,13:7058-7067. DOI:10.1039/c1ce05538k.
[17]崔躍 , 張寶祥 , 馬連彩 , 等 . 鎳鈦合金在醫療器械領域應用和表面改性研究進展 [J]. 材料導報 ,2017, 31(z2):197-200.
[18]Bacakova L, Filova E, Parizek M, et al. Modulation of cell adhesion, proliferation and differentiation o n m a t e r i a l s d e s i g n e d f o r b o d y i m p l a n t s [ J ] .Biotechnol Adv, 2011,29(6):739-767. DOI: 10.1016/j.biotechadv.2011.06.004.
[19]Hallab NJ, Bundy KJ, O'Connor K, et al. Evaluation of metallic and polymeric biomaterial surface energy and surface roughness characteristics for directed cell adhesion[J]. Tissue Eng, 2001,7(1):55-71. DOI:10.1089/107632700300003297.
[20]Rupp F, Liang L, Geis-Gerstorfer J, et al. Surface characteristics of dental implants: a review[J]. Dent Mater,2018,34(1):40-57. DOI: 10.1016/j.dental.2017.09.007.
[21]Alipour S, Taromian F, Ghomi ER, et al. Nitinol: from historical milestones to functional properties and biomedical applications[J]. Proc Inst Mech Eng H, 2022,236(11):1595-1612. DOI: 10.1177/09544119221123176.
無相關信息


yongyiti.com
永益鈦手機網