隨著全球老齡化人口的增加以及意外事故導致骨損失的案例越來越多,全球骨修復市場需求正大幅增加[1]。為了改善患者生活質量,外科手術中常采用人工植入物,以替換患者失效部位。臨床上常用的金屬植入材料一般包括鈦合金、不銹鋼以及鈷鉻合金等,主要作為人工關節、骨代替物等,替換患者受損或病變的硬質組織。

不銹鋼是發展較早,材料成本較低的金屬醫用植入材料,曾占據了較大部分的醫用金屬植入物市場。但由于不銹鋼的密度較大,患者異物感強,且 Fe 的耐蝕性較差,使用過程中磨損釋放的 Ni、Cr 離子對細胞毒副作用大等因素,其在植入體市場上的應用規模在不斷縮小。隨著生物醫用合金的更新發展,具有更好生物相容性的鈦及鈦合金產品近年來被廣泛的應用于骨組織修復上[2]。
目前,絕大多數醫用金屬骨植入市場的產品仍采用模具鑄造的生產加工方式。此類方法對產品尺寸區分度較小,無法滿足不同人種、性別、年齡及個體病例的個性化需求。同時,金屬材料的彈性模量比骨大,其與骨結合使用可能會產生“應力屏蔽”現象,長期使用則會導致病患處出現骨質疏松,甚至引起植入體滑落,導致種植失敗。因此,近年來,研究者們試圖利用多孔材料降低植入體彈性模量,提高植入體成功率。傳統的多孔材料制備方法包括粉末冶金法[3,4],漿料法[5,6]和纖維燒結法[7-9]等,但均因其技術特點,或多或少的影響材料力學性能或生物學性能,使其無法滿足植入體的各項需求,導致多孔生物植入體發展較為緩慢。
隨著 3D 打印裝備技術的不斷發展,利用 3D 打印技術制造醫用多孔材料的優勢越發明顯。3D 打印技術擁有極高的加工自由度,對于骨科材料的 3D 打印,其可以利用 CT、MRI 等醫學影像,通過計算機重建患者失效骨模型,制造出生物學性能與力學性能更與骨匹配的植入物產品[10,11],更可以針對每位患者制定獨特的治療方案,實現為骨植入患者“量體裁衣”的產品定制。3D 打印因為其層層加工的特點,可以方便的制造出各種孔型尺寸及具有仿生學效應和生物相容性的多孔材料,提高植入物的骨結合能力[10]。因此,3D
打印在醫用領域存在巨大的應用潛力。本文將主要介紹 3D 打印技術及其近年來在醫用多孔鈦合金研究上的應用進展。
1、 醫用鈦合金的種類及其應用情況
鈦及鈦合金,是 20 世紀中期才逐漸開始發展起來的一種金屬材料。其擁有密度低,比強度高,耐蝕性能好,生物相容性好等特點,被廣泛應用于航空航天、石油化工和醫療健康領域。對于鈦在醫療植入上的應用,早在 1940 年,就有學者報道了鈦植入物與小鼠股骨之間的惰性表現[12]。1951 年,又有學者進一步證實了純鈦相比其他傳統植入物材料,擁有更好的的生物相容性能[13]。但由于當時鈦合金生產成本高昂,不銹鋼在植入體市場已較成熟等原因,鈦合金在醫學領域的應用發展一直較為緩慢[14]。
自 20 世紀 60 年代,純鈦開始作為人體植入物被應用于臨床口腔研究[15]。隨著具有更加優異使用性能的 Ti-6Al-4V 合金的開發,鈦合金開始被廣泛應用于醫用植入 物市 場。雖 然 Ti-6Al-4V 的 彈性模 量僅 為114 GPa 左右,較不銹鋼、鈷鉻合金等其他生物材料低,但仍比人體皮質骨(15~25 GPa)[16]和松質骨(0.05~3 GPa)[17]高出一個數量級。如此大的差異會導致所謂的“應力屏蔽”效應發生,長期將會導致植入體周圍骨吸收,甚至導致植入體的滑落,降低骨植入的成功率。
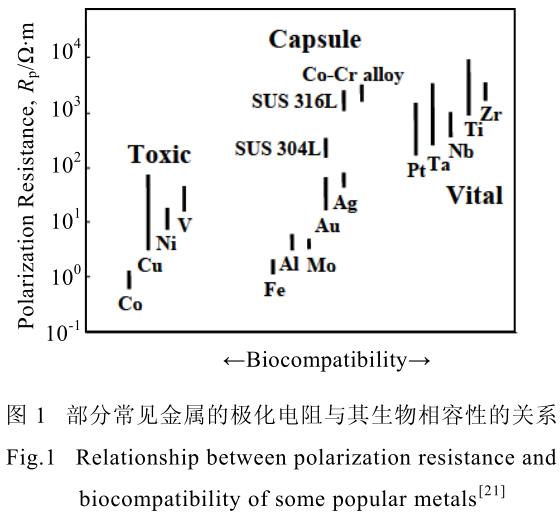
同時,其成分中所包含的 Al、V 等元素,均具有一定的生物毒性,長期在人體內使用會引起植入體周圍組織病變[18,19],誘發腦病、貧血等癥狀[20],并不適合長期在人體內使用。圖 1[21]展示了元素生物相容性與極化電阻的關系。近年來,針對生物用鈦合金,研究學者圍繞無毒、低彈性模量等特性,開發了諸如含有Ti-Nb-Ta-Zr 的 Gum 合金、含有 Ti-Nb-Zr-Mo-Sn 的 TLM合金以及含有 Ti-Nb-Zr-Sn 的 Ti2448 合金等等,這些合金均采用了生物相容性較好的 Nb、Zr、Mo 等元素。

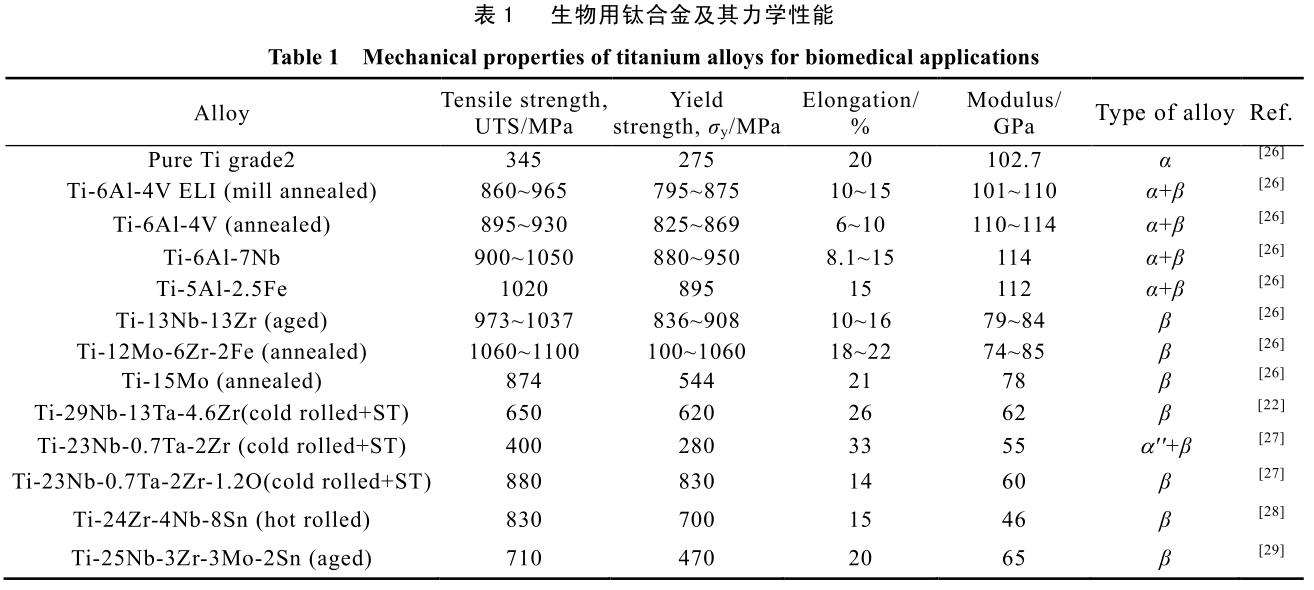
有實驗結果表明,此類鈦合金的骨促進性、致敏性等生物學表現均優于傳統植入物所采用的 Ti-6Al-4V 與Ti-6Al-7Nb[22-25]。表 1 總結了近年發表在各文獻中的生物用鈦合金的合金成分及其主要力學性能。
2 、多孔鈦合金制備與 3D 打印技術
鈦及鈦合金因為其良好的生物相容性、耐蝕性和力學性能,被廣泛的應用于骨組織修復。雖然鈦合金的彈性模量比不銹鋼或 Co-Cr 合金低,但傳統加工方法制造生產的致密鈦合金材料仍擁有較高的彈性模量。有研究數據表明,多孔材料的開發可有效地降低彈性模量,且為骨長入提供物理空間[30],增強骨固定。
對于骨植入多孔材料,有學者報道,其孔隙率應控制在 65%~80%之間[31,32]。對于孔隙率過大的植入體材料,孔隙率會顯著降低材料的抗壓強度與疲勞性能,幾乎無法滿足材料的正常使用需求;而低于這一值的多孔材料,由于致密度較高,影響骨組織長入材料內部,降低植入體與材料的結合強度。
為達到上述材料孔隙率的設計需求,傳統的多孔鈦合金材料制備方法主要包括如:粉末冶金法[3,4],漿料法[5,6]和纖維燒結法[7-9]等。但此類方法制作的多孔材料普遍孔徑較小,孔隙分布不均勻,通孔率不高,或孔壁結構上存在大量微孔,限制了其在生物材料領域的進一步發展。近年來,隨著“3D 打印”技術的提出,因其加工的特點,用 3D 打印來制造多孔材料的優勢越發明顯。表2 對比了幾種常見多孔材料制備方法的特點,圖 2 則展示了幾種常見多孔材料制備方法制備的多孔材料[6,9,33]。
3D 打印這一概念最早由美國學者于 20 世紀 80年代提出[34]。美國材料與試驗協會 ASTM 將增材制造或 3D 打印定義為“利用三維數據,通過層層相疊加結合的一種制作工藝”,擁有極高的加工自由度。但受限制于 3D 打印設備的發展,該技術在近十幾年才在生物材料應用研究制造方面有了較為迅猛的發展。


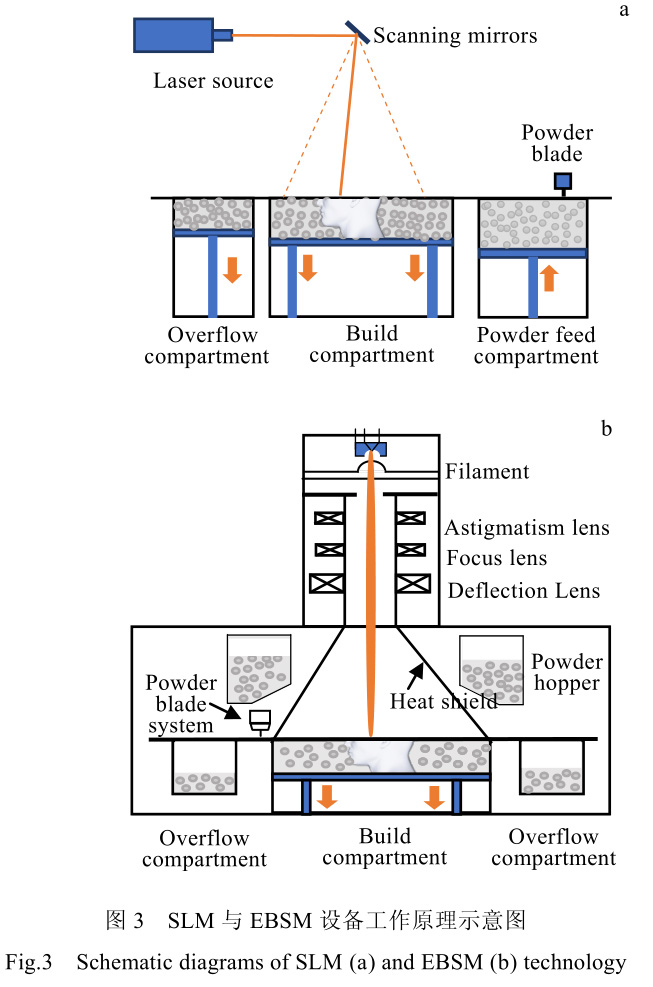
3D 打印設備,按照其供料方式、能量源等,可以分為近十種類別。對于包括醫用零件、小型航空航天零件的增材制造,現階段最為流行的打印制備方法包括激光選區熔化(selective laser melting, SLM)與電子束熔化(electron beam selective melting, EBSM)兩種[35,36]。此類方法可加工的零件尺寸一般小于 0.5 m,加工精度與成形質量較高。對于其中的 SLM 工藝,其是利用激光功率在 200~600 W 之間的激光束作為能量源,通過陣鏡偏轉,激光束選擇性的將指定區域金屬粉末逐層熔化凝固在一起,實現“三維打印”的目標。此方法制造出的金屬材料致密度很高,力學性能甚至可優于傳統鑄造方法加工的零件[37]。EBSM 工藝的工作原理在加工方式上與 SLM 工藝較為相似,但在能量源上采用更高能的電子束來代替激光。其利用偏轉線圈對射出的電子方向進行控制,選擇性的照射到粉床表面,使電子束入射位置附近的粉末熔化并逐層凝固在一起。
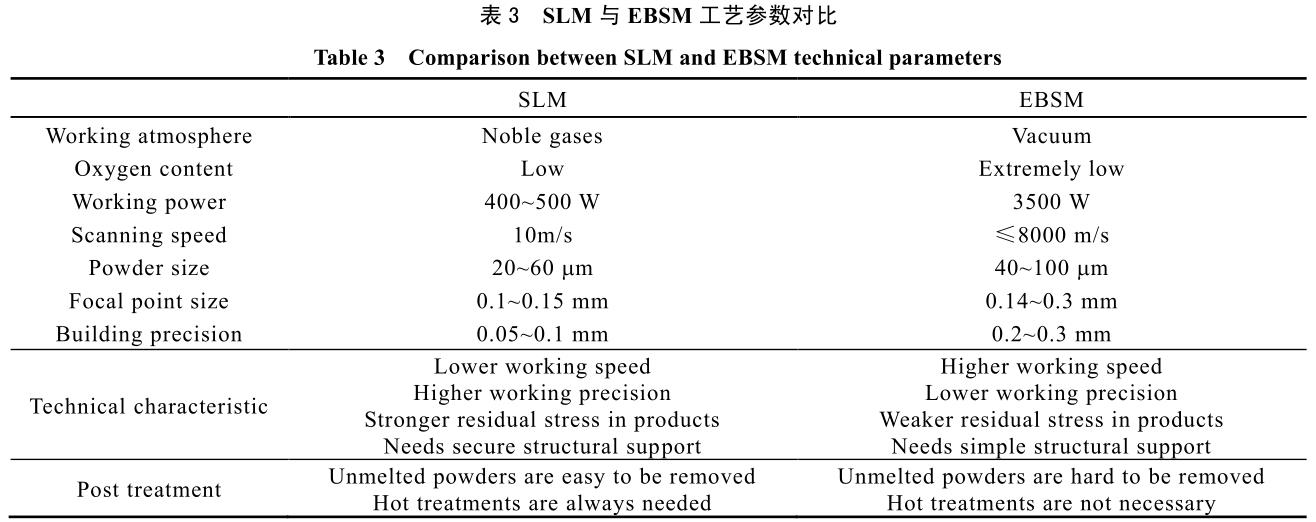
其常見電子束功率從 2 kW 至數十 kW,較激光能量高很多。因此,EBSM 方法對比 SLM 方法,具有加工速度快,但精度相對較低的特點。目前兩者都是金屬材料增材制造的最常見技術,其工作原理示意圖見圖 3。表 3 中則總結了兩種工藝參數等對比數據。
3、 3D 打印多孔鈦合金現狀
3.1 3D 打印醫用鈦合金植入體
縱觀國內外植入體市場,傳統的生產廠商主要包括 Stryker,Zimmer-Biomet,愛康醫療,威高骨科等。
其過往產品設計思路,往往根據統計大數據,設計生產一系列特定尺寸的植入體產品。對于個體差異較明顯或骨缺損較為特殊的部位,此類固定設計基本無法滿足各人種、性別、年齡階段的多樣化需求。對于骨損失部位較大或較特殊的患者,傳統的治療方案常包括要求患者面臨“削足適履”的窘境,加大手術風險與患者痛苦。隨著 3D 打印技術的發展,植入體的設計與生產部門的工程師們,可以根據病患的 CT 與 MRI等醫學影像,利用電腦軟件,重建患者的骨 3D 模型。再通過 3D 打印加工方法,輕松實現各種不同規格的
植入體生產,實施對患者進行“量體裁衣”的治療方案。面對全球人口老齡化的現狀以及人們對精準醫療的盼望與需求,3D 打印制造植入體的治療方案的優勢不容小視。
近年來,隨著 3D 打印設備價格不斷降低,3D 打印在醫療行業的應用逐漸擴大。許多研究機構與傳統醫療器械生產企業均已著力于 3D 打印醫療產品的研發與制造。利用 3D 打印制作了諸如牙冠、髖臼杯、椎間融合器等一系列植入物材料。2010 年,美國Exactech 公司的 3D 打印骨科植入體率先獲得了美國食品藥品管理局 FDA 的認證。我國的愛康醫療則于2015 年獲得首張中國國家食品藥品監督管理總局CFDA 頒發的 3D 打印植入物產品認證,打開了 3D 打印植入物市場商業化應用的大門。FDA 與 2017 年 12月發布了 3D 打印醫療器械技術指南,進一步規范了3D 打印醫用植入體的生產與檢測標準,為醫療器械廠商 3D 打印產品快速獲得 FDA 認證鋪平了道路。
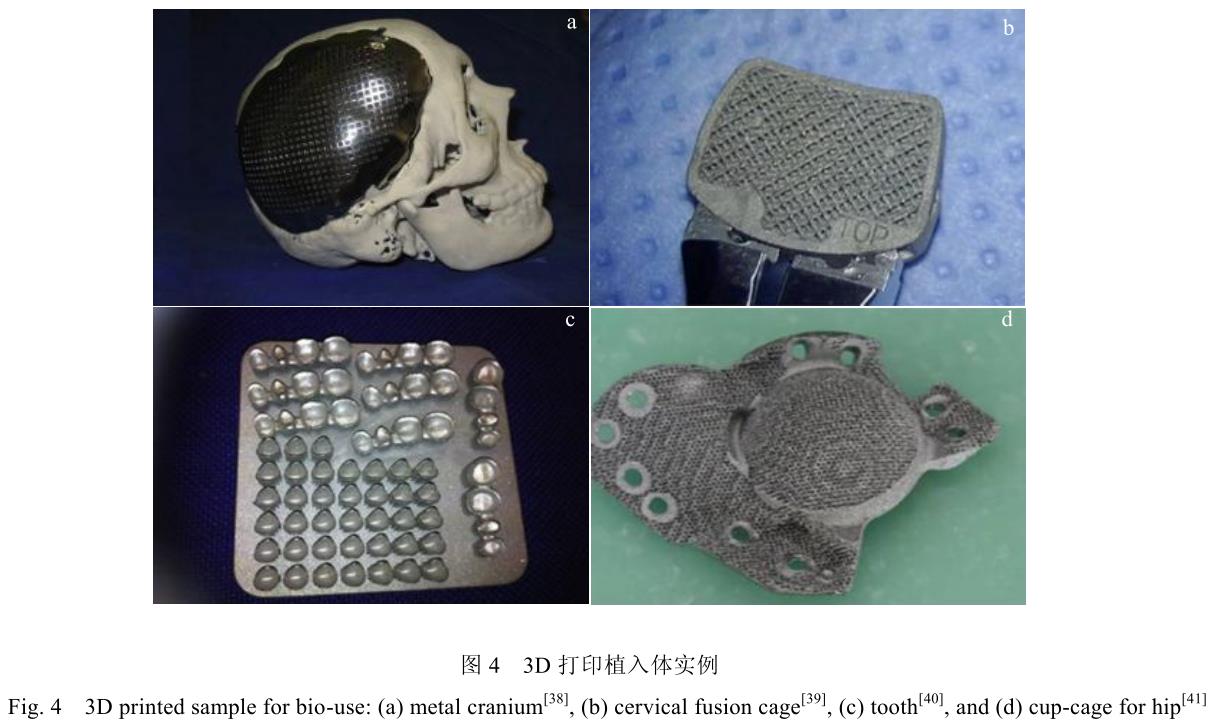
圖 4 展示了部分利用 3D 打印方法設計鈦合金植入材料改善患者手術方案的案例[38-41]。但由于 3D 打印制造加工過程不完全等同于傳統材料的加工方法,其制造零件的組織形態、力學性能與生物學性能等,仍需要研究者重新評估與考量。
3.2 3D 打印鈦合金植入體可加工性能研究
金屬植入材料具有力學強度要求高,外觀形狀復雜等特點。傳統金屬植入物常采用鑄造方法進行生產加工。由于 3D 打印特殊的加工方法,要求 3D 打印材料具有較高的能量吸收率與可焊性,材料的可加工性值得研究。3D 打印產品的力學性能與表面質量,主要取決于打印功率與掃描策略的配合。對于早期的 3D打印加工,因為其機器的局限性,加工能量源輸出功率不穩定,加工功率與掃描速度的配合不佳等原因,導致加工出的產品粉末熔化不完全,孔隙嚴重,致密度與力學強度均低于傳統鑄件。Abe 等人[42]曾在 2003年,利用 SLM 技術,采用平均粉末粒徑為 25 μm 的純鈦粉,以研究加工材料的致密度問題。然而,由于機器功率、掃描策略等問題,其得到了致密度僅約為92%的產品。
隨著近些年 3D 打印設備的不斷發展,Attar 等人[43]在 2014 年使用相近化學組成的原料和平均粉末粒徑更粗的純鈦粉(50 μm)(表 4),研究了不同打印參數設置對打印致密性的影響。如圖 5,其采用 3 種不同打印參數,得到致密度分別為 96.3% (P=85 W, v=71 mm/s)、98.7% (P=135 W, v=112 mm/s) 與 99.5% (P=165 W, v=138 mm/s)的純鈦零件,其致密度可達到傳統鑄件水平。對于增材制造材料的力學性能,多篇文獻指出,采用 SLM 及 EBSM 方法制造鈦及鈦合金產品,其耐磨性[44],顯微硬度、抗壓強度、抗拉強度[43,45] 等性能,均優于傳統鑄造材料。雖然 Edwards 等人[46]也在其文獻中提出,因 SLM 加工倉體溫度近似于室溫溫度,溫度梯度大,加工冷卻速度較快,經 SLM 加工后
的材料內部殘余應力來不及釋放,導致其抗疲勞強度略低于傳統鍛件。但 Mercelis 等人[47]在對 SLM 加工后的材料進行后續熱處理后,可有效去除殘余應力,進而改善其力學性能。因此利用 3D 打印技術改善現有醫用鈦合金植入物制造工藝,較為可行。

3.3 3D 打印鈦合金植入體顯微組織研究
金屬材料的顯微組織對材料的力學性能影響較大。3D 打印過程中,由于材料的加熱與冷卻速率與傳統加工方法差異較大,導致 3D 打印金屬材料顯微組織與傳統鑄造、鍛造后的顯微組織有明顯差異。例如,在利用 SLM 方法打印鈦合金零件的過程中,由于冷卻溫度梯度大,冷卻速率較高,在鈦合金的凝固過程中,鈦合金的?相轉變為?相的過程來不及進行,導致凝固組織中形成大量過飽和的針狀馬氏體?′[48,49]。且馬氏體尺寸與冷卻速率密切相關,當冷卻速率越高時,馬氏體的尺寸越細 [50]。因此,對比于其他傳統加工方法,3D 打印零件具有抗拉性能較高,延展性較差的特點。相比于 SLM 加工工藝,由于 EBSM 工藝加工過程中,基板溫度始終維持在較高溫度,且真空環境下,零件冷卻速度較慢,EBSM方法加工生產的鈦合金零件相比 SLM 方法加工的鈦合金零件,合金中的組織更為粗大,抗拉性能較低,延展性能更好。
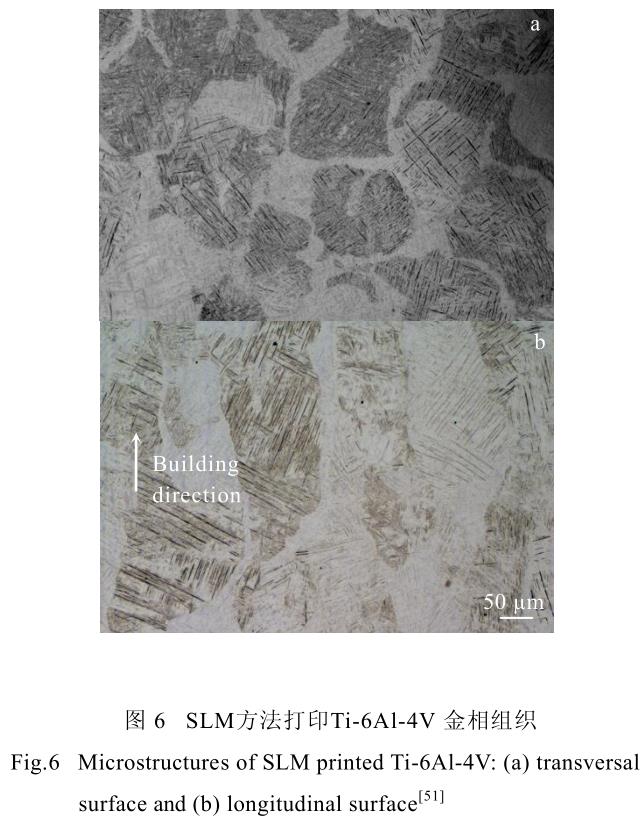
同時,沿建造方向生長的柱狀晶也是 3D 打印鈦合金及其他金屬材料的一個顯著特點。由于 3D 打印過程中,激光或電子束的能量較高,產生一定厚度的熱影響區,導致熔池深度超過粉末層厚度。此熱影響區會導致之前已經凝固的零件表面重新熔化凝固,在零件建造方向上累加形成較為粗大的柱狀晶[51],導致 3D打印零件各向異性明顯。圖 6 展示了 SLM 方法打印Ti-6Al-4V 合金橫縱截面的金相圖。圖中可明顯觀察到上述的針狀馬氏體相及沿建造方向生長的柱狀晶。
在圖 6 中,除了可以觀察到較為明顯的柱狀晶外,還可以較為清楚的觀察到左右斜向交錯的針狀馬氏體組織。通過分析其形態與形成機理,研究者們發現,該針狀馬氏體組織的傾斜方向與局部熱傳導方向密切相關,即與激光束或電子束的掃描方向密切相關。當激光束或電子束自左向右掃描時,晶格傾斜方向為“///”;而當激光束或電子束自右向左掃描時,晶格傾斜方向為“\\\”[48]。
此類特殊的顯微組織導致 3D 打印鈦合金材料具有明顯的各向異性,且此各向異性與 3D 打印加工過程中制定的加工掃描策略密切相關。因此,根據材料的種類及零件的用途,制定適當的 3D 打印加工策略,在 3D 打印加工零件的顯微組織與原始力學性能方面顯得尤為重要。
3.4 3D 打印多孔鈦合金植入體力學性能研究
“應力屏蔽”效應是生物材料學家在材料設計及加工過程中,常提到的一點問題。其是指生物植入體彈性模量(>100 GPa)與受體骨彈性模量(<20 GPa)的數值差異較大,導致植入體受力后變形程度與骨不一致,長期使用會引起植入體周圍骨質疏松與骨消融,最終導致植入體滑落的現象。適當降低彈性模量的方法是近年來生物材料研究學者的工作重點之一。通常,降低彈性模量的方法包括采用彈性模量較低的合金或利用多孔設計降低其零件強度。
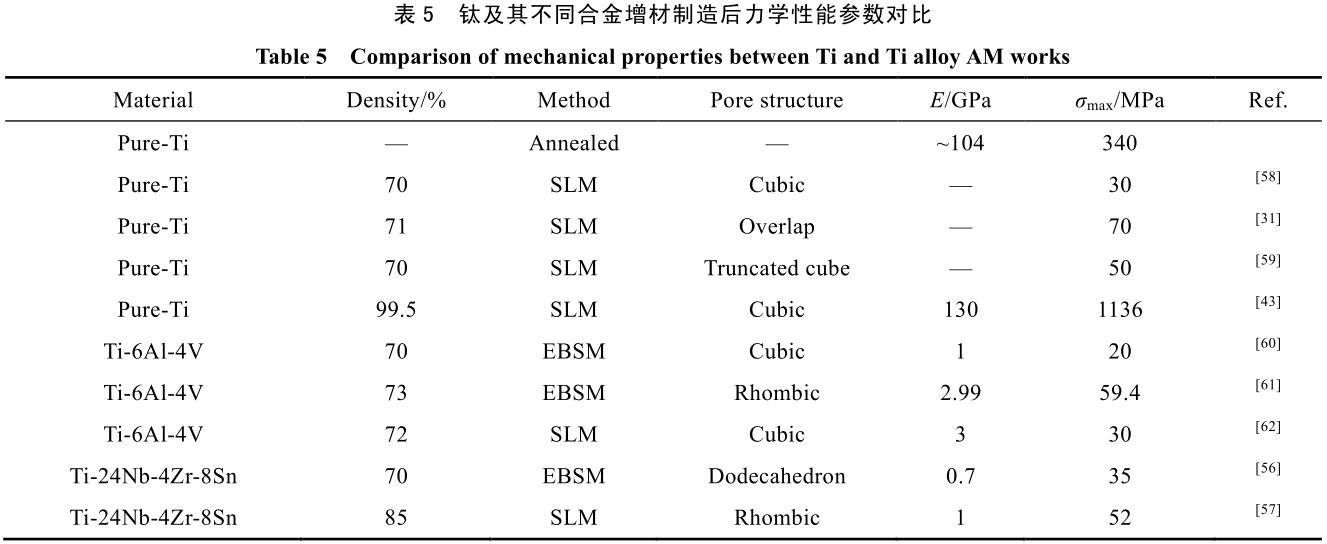
由于 3D 打印的加工方式可以簡便的實現毫米級多孔材料的設計,且其加工形狀并不受傳統加工方式的限制,是近年來最好的生物多孔材料的設計加工方法。表 5 展示了部分典型鈦及鈦合金增材制造方法制得的多孔部件的原料加工方式和力學性能等相關數據。
由表 5 可以看出,雖然多孔結構設計可以有效降低材料的彈性模量,但其抗壓強度等也會隨之大幅降低。Stamp 等人[31]曾提出,為達到骨組織長入等目的,植入材料孔隙率應大于 65%,彈性模量應低于 3 GPa,且抗壓強度同時不能低于 50 MPa。參照表 5 中的相關文獻可以發現,由于合金本身彈性模量與抗壓強度的關系,采用純鈦或 Ti-6Al-4V 等傳統增材制造合金基本無法同時滿足上述要求。因此,為進一步提升生物材料的各項性能,新型高強度低模量的新 β-鈦合金的開發就變成了當務之急。
由于 β-鈦合金其晶格結構為 bcc,較 hcp 結構的α-鈦合金或α+β 相的鈦合金相比擁有更低的彈性模量。Ozaki 等人[52]在 2004 年時采用傳統鑄造方法制作出致密的新型 β-Ti 合金 Ti-35Nb-2.5Sn,并測試其彈性模量為 50.7 GPa,僅為 Ti-6Al-4V 的一半。Zhang等人 [53]與 Hernandez 等人 [54]則分別采用 SLM 與EBSM 方法制造的致密 Ti-24Nb-4Zr-8Sn (Ti2448)合金,其彈性模量分別為 53 與 47 GPa,與其他傳統制造方法制造該合金的結果相似[28,55],證明了用增材制造方法制造純 β 鈦合金的可行性。通過增加孔隙率,
Liu 等人[56]利用 EBSM 3D 打印方法進一步降低了Ti2448 合金材料零件的彈性模量。其實驗中,當孔隙率為 70%時,Ti2448 的彈性模量僅為 0.7 GPa,抗壓強度為 35 MPa,為完全消除應力屏蔽創造了理論基礎。Liu 等人[57]在另一項的研究中,采用 SLM 方法實現了 85%孔隙率的 Ti2448 在維持彈性模量為 1 GPa的同時達到了 52 MPa 的抗壓強度,基本達到了骨植入材料的理想力學性能要求。
對于長時間作為承力件的植入體零件,其疲勞強度同樣十分重要。Edwards 等人[46]研究了 SLM 打印Ti-6Al-4V 合金塊體材料的疲勞性能。其發現,由于加工冷卻速度過快,3D 打印零件晶體內形成大量馬氏體,材料內的殘余應力無法釋放。同時,因為材料的位錯往往沿馬氏體晶界展開,加之 3D 打印材料內部可能會由于粉末熔化燒結不完全,存有孔洞,直接加工后的表面質量不高,3D 打印的塊體材料的疲勞強度遠低于鍛件[46]。同時,由于 3D 打印晶粒生長方向與加工方向密切相關,疲勞強度各向異性明顯。因此 3D
打印后的零件需要進行適當的熱處理以改善其力學性能。但對比其他多孔材料制備方法制造出的零件,3D打印方法生產出的零件的疲勞強度仍然較高。Li 等人[63]研究了 3D 打印多孔 Ti-6Al-4V 的疲勞強度。其利用 EBSM 方法制造了孔隙率在 60%~85%之間的Ti-6Al-4V 材料。通過對比不同結構的 Gibson-Ashby模型[64]的疲勞指數因子,發現 3D 打印規則 Ti-6Al-4V多孔材料的疲勞指數因子為隨機多孔材料的兩倍[63]。
說明 3D 打印是一種較為理想的多孔材料加工方法。
3.5 3D 打印鈦合金生物相容性研究
對于生物醫用合金的開發與設計研究,具有優異的生物相容性能是其重要的設計理念之一。利用 3D打印的鈦合金醫用材料,由于加工方式,導致零件表面粗糙度、孔隙度等均與傳統加工方式制造的零件有所差異。因此,3D 打印醫用鈦合金的生物相容性同樣十分值得研究。
對于傳統的生物材料相容性的研究,研究者常著重于分析元素的細胞毒性、細胞繁衍分化程度等因素。但對于 3D 打印鈦合金植入體而言,由于打印粉末原料大都采用現有合金成分,合金本身的生物學表現已經較明了。利用 3D 打印工藝制作的多孔材料與傳統方法加工的合金相比,并不會對細胞分化、免疫反應等產生新的不利影響[10]。現有 3D 打印材料的生物相容性研究多集中于 3D 打印加工方法所帶來的諸如粉末顆粒殘留、表面粗糙度變化、孔尺寸大小等因素對生物學表現的影響上。
對于傳統植入體,磨損產生的 5~10 μm 尺寸的碎屑會引起人體免疫系統過敏反應,已經成為生物材料的業界共識[65,66],此類碎屑經過復雜免疫反應過程后,會激活破骨細胞,導致骨消溶現象的發生[67]。由于 3D 打印工藝加工的多孔材料孔隙間隔較小以及粉末熔化不完全導致粉末粘連等因素,3D 打印材料孔隙內的細小粉末很難清理完全。Li 等人[68] 的研究證實,3D 打印后殘留的細小粉末顆粒同樣會引起類似的免疫系統反應,且隨著粉末重復利用次數的增加,粉末粘結現象會加劇,致敏現象會更加嚴重[68]。因此,如
何正確處理打印加工后的樣品是未來 3D 打印醫用植入體需要考量的問題。
細胞黏附率是研究植入物早期生物相容性的一個重要指標。由于 3D 打印的特殊工藝,導致 3D 打印產品表面較為粗糙,為細胞早期攀附創造了理想條件。
同時,適當的熱處理工藝可以進一步提高 3D 打印材料的表面粗糙度,進而提升骨細胞的黏附與骨結合。Li 等人[11]通過固溶+水冷的熱處理工藝,增加了 3D打印 Ti-6Al-4V 的表面粗糙度。相比于未經處理的 3D打印零件,其早期細胞黏附率可提升約 50%,且后期骨長入率與骨結合強度均高于未經過處理的零件。
3D 打印多孔零件的孔型與孔徑尺寸的設計也是3D 打印工藝設計過程中需要考慮的問題。由于 3D 打印具有極高的設計加工空間,3D 打印醫用鈦合金的孔型與大小設計十分豐富。對于孔形狀的設計,雖有部分報道涉及孔形狀對細胞黏附于增值的影響,但對于何種孔型對細胞更有促進效應,目前并無明確定論[69,70]。對于孔徑尺寸的設計,由于該變量與材料的力學性能與骨細胞生長等因素密切相關,研究的關注度較多。Warnke 等人 [10]就曾利用 SLM 方法制備Ti-6Al-4V 合金 0.45~1.2 mm 孔徑尺寸的多孔材料,在體外培養人成骨細胞,以研究不同孔徑尺寸對骨結合性能的影響。其研究發現,當孔徑大于 0.7 mm 時,成骨細胞數量逐漸減少,骨組織無法長滿全部孔洞;孔尺寸為 0.5~0.6 mm 時,成骨細胞生長最為繁茂,可填滿整個孔隙。Taniguchi 等人[71]則將 SLM 打印純鈦多孔材料植入兔子體內,并研究其在活體中的生物相容性與力學表現。其同樣發現,0.6 mm 大小孔洞與其他孔徑大小的孔洞(0.3 與 0.9 mm)相比,骨組織長入與結合能力更好。
4 、3D 打印醫用鈦合金問題與發展建議
隨著 3D 打印技術的不斷進步與發展,3D 打印醫用鈦合金產品逐步被醫患所認知與接受。其技術優勢對醫療領域的革命創新是顯而易見的。然而,3D 打印醫用鈦合金領域仍存在許多問題有待完善。例如,3D 打印用粉末成本較高。目前,我國 3D打印用粉末的生產以旋轉電極法和氣霧化法為主,該類方法的細粉收得率不高,可用于 3D 打印的球形粉末出粉率基本低于 30%。同時,國內高端制粉設備仍以國外進口為主,粉末產品批次穩定性較差,導致制粉成本高昂,粉末售價為其原材料的 10 倍以上。
3D 打印用的鈦合金粉末種類十分有限。受制于粉末生產技術與粉末生產成本的限制,市面上的鈦合金3D 打印用粉末仍以純鈦或 Ti-6Al-4V 粉末為主。盡管近 20 年,各國研究者針對醫用鈦合金的需求研發了數款具有良好生物相容性的鈦合金產品,但新型鈦合金在 3D 打印上的研究與應用仍十分有限。
3D 打印產品的性能穩定性有待提高。受限于粉末批次穩定性與設備工藝的限制,3D 打印所得產品的穩定性同樣不佳。由于各廠商生產粉末的物理性能與化學性能均有所差異,導致打印工作前常需要根據粉末性能調整摸索加工工藝參數。打印過程中無法對加工過程進行實時監控與評價,難以及時發現問題,對 3D打印工程師的技術水平與經驗要求較高。
3D 打印零件組織缺陷難以避免。由于 3D 打印鈦合金的過程中,打印零件冷卻速度較快,難以避免的出現馬氏體組織。且加工過程中不均勻溫度場引起的殘余應力難以釋放,嚴重時可能造成零件變形。加工方式導致 3D 打印材料各項異性明顯。因此 3D 打印零件的加工過程控制及零件的后續處理值得深入研究。
對于 3D 打印植入物產品沒有完善的評價體系。盡管自 2010 年 FDA 頒發了首張 3D 打印骨科植入產品的許可證起,FDA 已經批準了上百種 3D 打印的醫療器械產品,但其中金屬植入物產品及種類仍有限,且絕大多數為脊柱椎體、椎間融合器與髖臼杯等統一設計的產品。對于針對患者定制的個性化產品,由于FDA 與 CFDA 對于 3D 打印產品并無單獨的評價體系,導致此類產品很難獲得市場準入認證,僅能停留在臨床試驗階段,無法發揮 3D 打印醫療器械的最大優勢。
綜上所述,對于促進 3D 打印醫用鈦合金在醫療領域的進一步發展,以下工作有待進一步推進:
1) 改進金屬球形粉末制備方法,建立 3D 打印金屬粉末原料的標準與規范,提高 3D 打印用粉末細粉收得率與批次穩定性。
2) 增加 3D 打印粉末的多樣化,盡快引入新型醫用鈦合金在 3D 打印上的應用與研究。通過與材料基因組研究計劃的結合,突破現有材料瓶頸,開發更適合 3D 打印工藝的新材料。
3) 建立設備-材料-工藝的協同發展機制,制定針對材料與設備相結合的 3D 打印加工工藝,以生產出性能更優異、批次穩定性更強的 3D 打印產品。
4) 加大 3D 打印材料及方法在醫療應用準入許可上的推動力度,針對 3D 打印加工方法,設立相關國家和行業標準與評價體系,降低 3D 打印技術的推廣應用門檻,使這項技術造福于民。
參考文獻 References
[1] Geetha M, Singh A K, Asokamani R et al. Progress inMaterials Science[J], 2009, 54(3): 397
[2] Wang Yunfeng(王運鋒), He Lei(何 蕾), Guo Wei(郭 薇).Titanium Industry Progress(鈦工業進展)[J], 2015, 32(1): 1
[3] Liu P S, Liang K M. Journal of Materials Science[J], 2001,36(21): 5059
[4] Wen C E, Mabuchi M, Yamada Y et al. Scripta Materialia[J],2001, 45(10): 1147
[5] Li J P, Li S H, Groot K D et al. Preparation andCharacterization of Porous Titanium[C]. Switzerland:Trans Tech Publications, 2002: 51
[6] Zhang Q Y, Leng Y, Xin R L. Biomaterials[J], 2005, 26(16):2857
[7] Kitaoka K, Yamamoto H, Toshikazu Tani et al. Journal ofOrthopaedic Science[J], 1997, 2(2): 106
[8] He G, Liu P, Tan Q B. Journal of the Mechanical Behavior ofBiomedical Materials[J], 2012, 5(1): 16
[9] Xu Guangsheng( 徐 廣 勝 ), Kou Hongchao( 寇 宏 超 ), LiuXianghong( 劉 向 宏 ) et al. Rare Metal Materials andEngineering(稀有金屬材料與工程)[J], 2014, 43(11): 2778
[10] Warnke P H, Douglas T, Wollny P et al. TissueEngineering Part C: Methods[J]. 2009, 15(2): 115
[11] Li Z H, Liu C, Wang B F et al. RSC Advances[J], 2018,8(22): 12 471
[12] Bothe T R. Sur Gynecol Obst[J], 1940, 71(6): 598
[13] Leventhal G S. J Bone Joint Surg Am[J], 1951, 33(2): 473
[14] Yu Zhentao(于振濤), Yu Sen(余 森), Zhang Minghua(張明華) et al. Materials China(中國材料進展)[J], 2010(12): 35
[15] Noort R V. Journal of Materials Science[J], 1987, 22(11):3801
[16] Reilly D T, Albert H Burstein. The Journal of Bone &Amp;Joint Surgery[J], 1974, 56(5): 1001
[17] Goldstein S A. Journal of Biomechanics[J], 1987, 20(11):1055
[18] Boyce B F, Byars J, Williams S Mc et al. Journal ofClinical Pathology[J], 1992, 45(6): 502
[19] Niinomi M, Nakai M, Hieda J. Acta Biomaterialia[J], 2012,8(11): 3888
[20] Aschner M, Costa L G. Neurotoxicity of Metals[M]. NewYork: Springer International Publishing, 2017: 183
[21] Steinemann S G. Evaluation of Biomaterials[J], 1980, 1: 1
[22] Niinomi M. Biomaterials[J], 2003, 24(16): 2673[23] Stenlund P,Omar O,Brohede U et al. ActaBiomaterialia[J], 2015, 20: 165
[24] Bai Y, Li S J, Prima F et al. Applied Surface Science[J],2012, 258(8): 4035
[25] Yu S, Yu Z T, Wang G et al. Colloids and Surfaces B:Biointerfaces[J], 2011, 85(2): 103
[26] Niinomi M. Materials Science and Engineering A[J], 1998,243(1-2): 231
[27] Besse M, Castany P, Gloriant T. Acta Materialia[J], 2011,59(15): 5982
[28] Zhang S Q, Li S J, Jia M T et al. Scripta Materialia[J], 2009,60(8): 733
[29] Kent D, Wang G, Yu Z et al. Materials Science andEngineering: A[J], 2010, 527(9): 2246
[30] Li S J, Zhao S, Hou W T et al. Advanced EngineeringMaterials[J], 2016, 18(1): 34
[31] Stamp R, Fox P, O′ Neill W et al. J Mater Sci Mater Med[J],2009, 20(9): 1839
[32] Mullen L, Stamp R C, Fox P et al. J Biomed Mater Res BAppl Biomater[J], 2010, 92(1): 178
[33] Sallica-Leva E, Jardini A L, Fogagnolo J B . Journal of theMechanical Behavior of Biomedical Materials[J], 2013, 26: 98
[34] Frazier W E. Journal of Materials Engineering andPerformance [J], 2014, 23(6): 1917
[35] Vayre B, Vignat F, Villeneuve F. Mechanics & Industry[J],2012, 13(2): 89
[36] Murr L E, Gaytan M, Ramirez D A et al. Journal ofMaterials Science & Technology[J], 2012, 28(1): 1
[37] Attar H, B?nisch M, Calin M et al. Journal of MaterialsResearch[J], 2014, 29(17): 1941
[38] Jardini A L, Larosa M A, Filho R M et al. Journal ofCranio-Maxillofacial Surgery[J], 2014, 42(8): 1877
[39] Spetzger U, Frasca M, K?nig S A. European SpineJournal[J], 2016, 25(7): 2239
[40] Noort R van. Dent Mater[J], 2012, 28(1): 3[41] Wang S, Wang L, Liu Y et al. Experimental andTherapeutic Medicine[J], 2017, 14(3): 2595
[42] Abe F, Santos E C, Kitamura Y et al. Proceedings of theInstitution of Mechanical Engineers, Part C[J], 2003,217(1): 119
[43] Attar H, Calin M, Zhang L C et al. Materials Science andEngineering: A[J], 2014, 593: 170
[44] Hrabe N, Gn?upel-Herold T, Quinn T. InternationalJournal of Fatigue[J], 2017, 94: 202
[45] Attar H, Prashanth K G, Chaubey A K et al. MaterialsLetters[J], 2015, 142: 38
[46] Edwards P, Ramulu M. Materials Science and Engineering:A[J], 2014, 598: 327
[47] Mercelis P, Kruth J P. Rapid Prototyping Journal[J], 2006,12(5): 254
[48] Thijs L, Verhaeghe F, Craeghs T et al. Acta Materialia[J],2010, 58(9): 3303
[49] Murr L E, Esquivel E V, Quinones S A et al. MaterialsCharacterization[J], 2009, 60(2): 96
[50] Gu D, Hagedorn Y C, Meiners W et al. Acta Materialia[J],2012, 60(9): 3849
[51] Vrancken B, Thijs L, Kruth J P et al. Acta Materialia[J],2014, 68: 150
[52] Ozaki T, Matsumoto H, Watanabe S et al. MaterialsTransactions [J], 2004, 45(8): 2776
[53] Zhang L C, Klemm D, Eckert J et al. Scripta Materialia[J],2011, 65(1): 21
[54] Hernandez J, Li S J, Martinez E et al. Journal of MaterialsScience & Technology[J], 2013, 29(11): 1011
[55] Li S J, Cui T C, Hao Y L et al. Acta Biomaterialia[J], 2008,4(2): 305
[56] Liu Y J, Li S J, Hou W T et al. Journal of Materials Science& Technology[J], 2016, 32(6): 505
[57] Liu Y J, Li X P, Zhang L C et al. Materials Science andEngineering A[J], 2015, 642: 268
[58] Mullen L, Stamp R C, Brooks W K et al. J Biomed MaterRes B Appl Biomater[J], 2009, 89(2): 325
[59] Pattanayak D K, Matsushita T, Takadama H et al.Bioceramics Development and Applications[J], 2010, 1: 1
[60] Li S J, Xu Q S, Wang Z et al. Acta Biomaterialia[J], 2014,10(10): 4537
[61] Cheng X Y, Li S J, Murr L E et al. J Mech Behav BiomedMater[J], 2012, 16: 153
[62] Ahmadi S, Yavari S, Wauthle R et al. Materials[J], 2015,8(4): 1871
[63] Li S J, Murr L E, Cheng X Y et al. Acta Materialia[J], 2012,60(3): 793
[64] Gibson L J, Ashby M F. Cellular Solids: Structure andProperties [M]. Cambridge: Cambridge University Press,1999
[65] Salda?a L, Vilaboa N. Acta Biomaterialia[J], 2010, 6(4):1649
[66] Akisue T, Thomas W B, Carol F F et al. Journal ofBiomedical Materials Research[J], 2001, 59(3): 507
[67] Lin T H, Yao Z Y, Sato T S et al. Acta Biomaterialia[J],2014, 10(8): 3747
[68] Li C D, Jiang C, Peng M Z et al. RSC Advances[J], 2018,8(4): 2229
[69] Markhoff J, Wieding J, Weissmann V et al. Materials[J],2015, 8(8): 5490
[70] Bael S Van, Chai Y C, Truscello S et al. Acta Biomater[J],2012, 8(7): 2824
[71] Taniguchi N, Fujibayashi S, Takemoto M et al. MaterialsScience and Engineering C[J], 2016, 59: 690
相關鏈接



















